for PATIENTS/DONORS患者さま・ドナーの方へ
生体肝移植を受ける患者さんとそのドナーの方へ
免疫寛容を誘導する、
新しい再生医療等製品の医師主導治験について
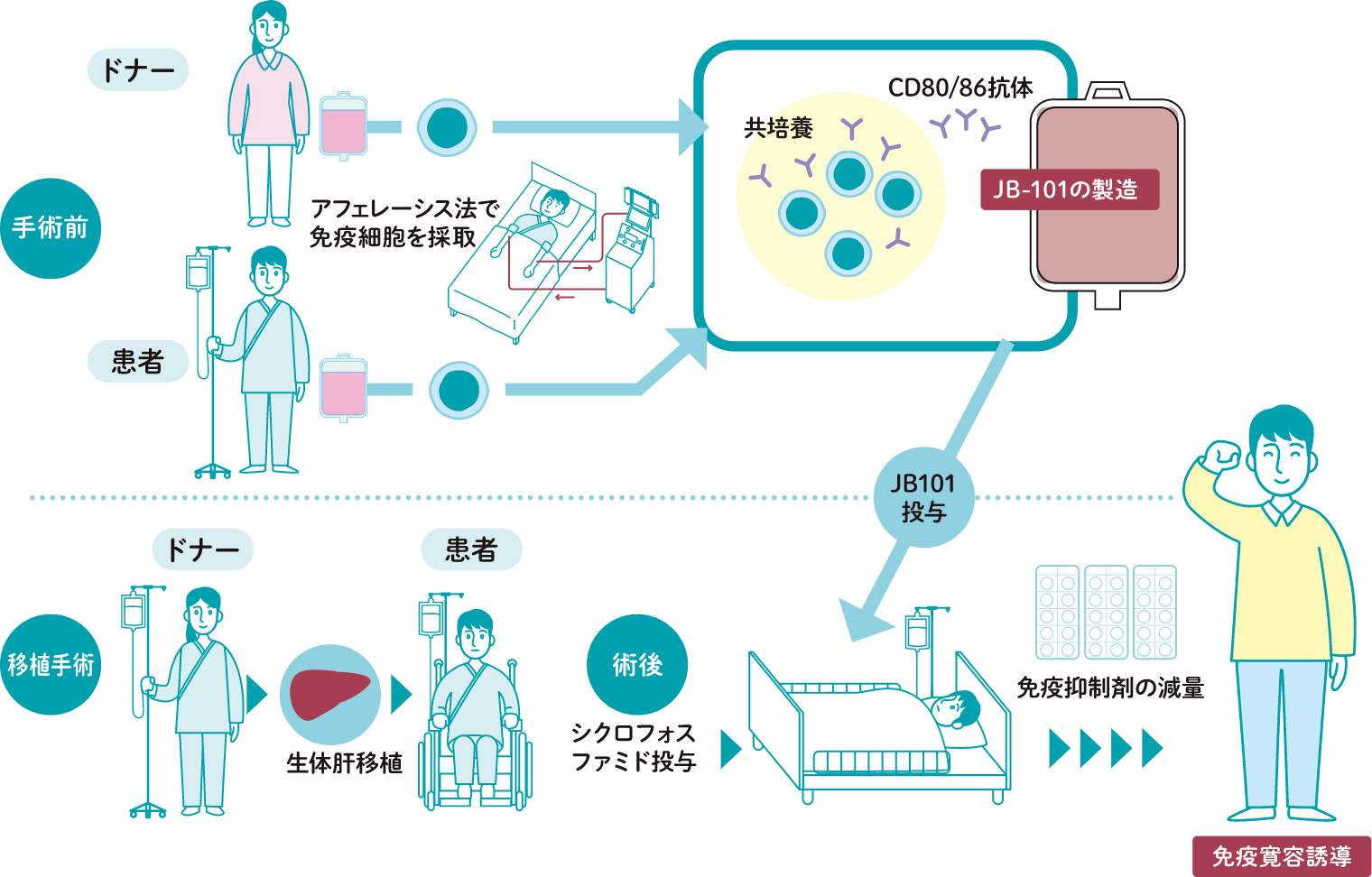
移植後に起こる拒絶反応を抑える、新しい再生医療等製品(JB-101)の医師主導治験を実施しています。JB-101は移植を受ける患者さんの免疫細胞とドナーの方の免疫細胞を用いて製造します。
そのため、ドナーの方へもご協力をお願いしています。

免疫抑制剤は大切なお薬ですが、副作用のリスクもあります。特に、免疫反応を抑えるため、感染症への注意が必要です。また、ワクチンの効果が低くなりやすいとの報告もあります。その他、高血圧や糖尿病などの代謝性疾患、がんの再発、腎機能障害、神経障害等が知られています。
現在、JB-101の医師主導治験に参加いただける患者さんとそのドナーの方を募集しています。
治験とは、開発中のお薬や製品を患者さんに使っていただき、効果や安全性を調べる試験のことです。試験の結果厚生労働省に承認されたお薬や製品が患者さんの診療に使われています。今回はこの治療法の開発をしてきた医師達が治験を実施しており、このような治験を、医師主導治験と言います。
臨床試験情報、研究情報を公開しています。詳しくはこちら
治験に参加いただく患者さんへ
主な参加条件
移植患者さん
- 20歳以上、80歳未満
- 実施医療機関において、生体肝移植の実施が認められることが予定されている方
- 高度な心疾患・劇症肝炎・腎疾患・悪性腫瘍(肝細胞癌を除く)・免疫不全のない方
- 妊娠・授乳中ではない方
※その他にも参加基準があります。 患者さんやドナーの方の状態によっては参加いただけない場合があります。
治験の流れ
STEP1
参加基準の確認
治験に参加いただく患者さん・ドナーの方両方に基準があります。 基準に合っているかを最初に調べます。
STEP2
リンパ球の採取
移植手術の前に、患者さん・ドナーの方の両者から、リンパ球を採取します。
STEP3
肝移植手術・免疫抑制剤の投与
肝移植手術後は通常通りに免疫抑制剤の服用を開始します。
STEP4
JB-101の投与
肝移植手術の一定期間後にJB-101を投与します。JB-101投与前に、もともと体内に存在しているリンパ球を減らす目的のお薬も使います。
STEP5
免疫抑制剤の減量・投与終了
拒絶反応がないことを確認しながら、少しずつ免疫抑制剤を減量し、投与を終了します。
STEP6
免疫抑制剤終了後
約1年間くわしい診察や検査を継続します。
実施医療機関
以下の3つの医療機関で実施しています。 参加いただいた患者さん及びドナーの方は、継続して通院いただく必要があります。 参加希望、その他のご連絡はこのホームページの「お問い合わせ」よりお願いします。 医療機関への直接のお問い合わせはお控えください。
- 長崎大学病院
- 東京女子医科大学病院
- 広島市内の医療機関
治験のお申し込み、お問い合わせ
順天堂免疫寛容プロジェクトが実施する医師主導治験のお申し込み、お問い合わせはこちらから受け付けております。
- トップページ
- 患者さま・ドナーの方へ
